Fake news
Anvisa esclarece pesquisas sobre medicamentos contra a Covid-19
A Agência Nacional de Vigilância Sanitária (Anvisa) publicou nota com esclarecimentos sobre as pesquisas clínicas sobre o novo coronavírus (Covid-19). Segundo a Anvisa, a iniciativa foi tomada após o aumento nas informações a respeito de possíveis medicamentos contra o vírus e visa combater notícias falsas, as chamadas fake news, sobre o tema.
Em nota, publicada na sexta-feira (24), a Anvisa cita o medicamento hidroxicloroquina e ressalta que, mesmo conhecido no mercado, há a necessidade de pesquisas clínicas, com testes em seres humanos, para comprovar se o medicamento é eficaz.
“No caso da hidroxicloroquina, por exemplo, os pesquisadores precisam testar sua eficácia e segurança para o tratamento da Covid-19. Até então, seu uso é indicado para outras doenças, como lúpus eritematoso, malária e artrite reumatoide”, informa a Anvisa.
A Agência diz ainda que não existe nenhuma pesquisa concluída sobre a eficácia da hidroxicloroquina no tratamento do coronavírus. “Se a pesquisa clínica for bem-sucedida, o medicamento pode ser registrado na Anvisa e receberá nova indicação em bula”.
Sobre o uso de medicamentos experimentais, aqueles ainda não aprovados pela Agência e registrados no Brasil, a Anvisa informa a utilização pode ser feita, desde que prescrita por profissionais de saúde. Esse uso ocorre por meio de programas específicos, desde que o protocolo da medicação seja aprovado pela Agência antes de sua administração no paciente.
“Esses programas disponibilizam medicamentos inovadores e promissores a pacientes portadores de doenças debilitantes graves para as quais não existe medicamento ou cujo tratamento disponível é insuficiente”, diz a Anvisa.
De acordo com a Agência, todas as pesquisas têm o acompanhamento de comitês de ética, em especial os Comitês de Ética em Pesquisa (CEPs) e a Comissão Nacional de Ética em Pesquisa (Conep), ligada ao Conselho Nacional de Saúde (CNS) responsáveis por estabelecer as diretrizes e normas para a proteção dos participantes de pesquisas. O acompanhamento visa “salvaguardar a integridade física e psíquica dos sujeitos envolvidos.”
Perguntas e respostas
O que é um ensaio clínico?
O ensaio clínico é um estudo sistemático de medicamentos em voluntários humanos. Dito de outra forma: são testes realizados em seres humanos após a execução dos chamados testes in vitro e in vivo, que são aqueles preliminares desenvolvidos em ambientes controlados, nos laboratórios, com células e animais.
Para que servem os ensaios clínicos?
Os ensaios clínicos são conduzidos para definir a segurança e a eficácia de um medicamento, ou seja, para verificar se o produto investigado trata, conforme o esperado, a doença. Além disso, buscam analisar os efeitos e as reações adversas, bem como a toxicidade do produto e as dosagens adequadas para cada tratamento.
Os ensaios ou pesquisas clínicas realizados no Brasil necessitam, obrigatoriamente, da aprovação da Anvisa?
Não. Somente os ensaios ou pesquisas clínicas conduzidos no país para fins regulatórios, ou seja, com o objetivo de obter o registro de um produto para posterior comercialização, devem ser aprovados pela Agência antes do início dos estudos. As pesquisas que não têm essa finalidade – aquelas realizadas, exclusivamente, em caráter científico ou acadêmico – estão dispensadas da autorização da Anvisa, porém, precisam da aprovação da instância ética.
É preciso fazer ensaio clínico para novos usos de um medicamento que já está no mercado, como no caso da hidroxicloroquina?
Sim, os ensaios clínicos também são realizados para avaliar novas indicações para um medicamento que já é comercializado para outro fim. No caso da hidroxicloroquina, por exemplo, os pesquisadores precisam testar sua eficácia e segurança para o tratamento da Covid-19. Até então, seu uso é indicado para outras doenças, como lúpus eritematoso, malária e artrite reumatoide. Não existe ainda nenhum ensaio clínico concluído que comprove os benefícios da hidroxicloroquina no caso da Covid-19. Se a pesquisa clínica for bem-sucedida, o medicamento pode ser registrado na Anvisa e receber a nova indicação em bula.
De que forma são publicados os ensaios clínicos autorizados pela Anvisa?
Todos os ensaios clínicos deferidos, ou seja, cuja realização é autorizada pela Anvisa, são publicados no Diário Oficial da União em formato de Resoluções Específicas (REs) e também aqui, no portal.
Quem monitora os aspectos éticos dos ensaios clínicos?
A avaliação dos aspectos éticos é de responsabilidade dos Comitês de Ética em Pesquisa (CEPs) e da Comissão Nacional de Ética em Pesquisa, a Conep, que está diretamente ligada ao Conselho Nacional de Saúde (CNS). A Comissão é formada por representantes de diferentes áreas, como Biomédicas, Ciências Humanas e Ciências Sociais. É a Conep que elabora e atualiza as diretrizes e normas para a proteção dos participantes de pesquisas.
Todos os ensaios clínicos devem passar pela instância ética?
Sim. Há aspectos éticos envolvidos em todos os ensaios clínicos, mesmo aqueles de caráter científico ou acadêmico, que, necessariamente, precisam ser avaliados e aprovados antes do início dos estudos. O objetivo é salvaguardar a integridade física e psíquica dos sujeitos envolvidos.
Um medicamento ainda não aprovado no Brasil pode ser utilizado?
O chamado medicamento experimental, aquele ainda não aprovado e registrado no Brasil, pode ser prescrito por profissionais de saúde por meio de três programas específicos: programa de uso compassivo de medicamentos, acesso expandido de medicamentos e fornecimento de medicamento pós-estudo. Esses programas disponibilizam medicamentos inovadores e promissores a pacientes portadores de doenças debilitantes graves para as quais não existe medicamento ou cujo tratamento disponível é insuficiente. Nesses casos, o protocolo de uso do produto deve ser aprovado pela Anvisa antes de sua administração, conforme definido pela Resolução da Diretoria Colegiada (RDC) 38/2013.
Há algum documento da Anvisa que oriente a condução dos ensaios clínicos diante da pandemia do novo coronavírus?
A Nota Técnica 14/2020, publicada em 22/4, reúne uma série de orientações a patrocinadores, centros de pesquisa e investigadores envolvidos na condução de ensaios clínicos e estudos de bioequivalência. O documento, uma atualização da Nota Técnica 3/2020, tem como objetivo viabilizar de forma mais rápida a condução das pesquisas, garantindo a segurança dos participantes e os princípios de boas práticas, além de minimizar os riscos à integridade dos estudos realizados nesse período.
Quanto tempo a Agência leva para responder um pedido de autorização de estudo clínico?
Por conta da criação do Comitê de Avaliação de Estudos Clínicos, Registro e Pós-registro de medicamentos para prevenção ou tratamento da Covid-19, tem sido possível dar respostas às requisições de anuência dos estudos clínicos no prazo médio de 72 horas após a submissão formal do protocolo. É importante observar que o prazo foi reduzido devido à força-tarefa composta por um grupo de especialistas que se dedicam somente a essas análises.

#VacinaBrasil
Especialista reforça importância da imunização contra o sarampo

Após o Brasil recuperar, em novembro de 2024, o status de “país livre do sarampo” pela Organização Pan-Americana da Saúde (OPAS), a confirmação de quatro casos da doença no primeiro trimestre de 2025 reacende a preocupação e reforça a importância da vacinação e de medidas preventivas. Três casos foram registrados em municípios do Rio de Janeiro e um caso foi importado no Distrito Federal, envolvendo uma mulher de 35 anos que viajou por diversos países.
A docente Profª Janize Silva Maia, da Escola da Saúde do Centro Universitário Facens, esclarece que é natural a preocupação sobre o assunto. “Embora considerados casos isolados, o Ministério da Saúde está adotando medidas para afastar a possibilidade de novos surtos. Isso porque, a infecção compromete o sistema imunológico e pode levar a complicações graves, especialmente em crianças menores de cinco anos, gestantes e pessoas com imunidade debilitada. Dentre as complicações mais severas estão pneumonia, encefalite e a panencefalite esclerosante subaguda, em casos raros”.
O sarampo é uma doença viral altamente contagiosa que se caracteriza inicialmente por febre alta (acima de 38,5 °C), tosse seca, coriza e conjuntivite, sintomas que podem ser confundidos com um quadro gripal ou alérgico. “Dias depois, surgem erupções vermelhas não pruriginosas, principalmente no rosto e atrás das orelhas, que se espalham para o restante do corpo. Outras manifestações podem incluir dor de garganta, manchas brancas na cavidade bucal, dores musculares, fadiga e irritação nos olhos”, explica.
Para a profissional, dentre as medidas para manter o Brasil livre do sarampo, a fundamental é a vacinação. “A imunização em massa não só reduz a disseminação do vírus, mas também promove proteção às populações vulneráveis, evitando surtos da doença. Campanhas têm sido reforçadas em diversas regiões do país para garantir altas taxas de cobertura vacinal e impedir a reintrodução do vírus”, comenta.
Quem pode se vacinar?
O imunizante que previne o sarampo é a vacina tríplice viral, responsável também pela prevenção da caxumba e rubéola. Devem buscar uma unidade de saúde:
Qualquer pessoa entre 1 e 29 anos deve receber duas doses, sendo a primeira com a tríplice viral aos 12 meses e a segunda aos 15 meses com a tetraviral ou tríplice viral + varicela.
Pessoas entre 30 e 59 anos devem receber uma dose da tríplice viral, se não imunizadas anteriormente, e trabalhadores da saúde devem receber duas doses, independentemente da idade, com intervalo de 30 dias entre as doses.
É importante ressaltar que essa vacina é contraindicada para gestantes, que deverão tomá-la somente após o nascimento do seu bebê.
“Pessoas que não sabem se foram imunizadas ou com quaisquer dúvidas devem procurar as Unidades Básicas de Saúde (UBSs) para receberem informações sobre a sua situação e, eventualmente, tomarem a vacina. Manter a vacinação em dia é essencial para prevenir o sarampo e proteger a nossa saúde e a da nossa coletividade”, reforça a especialista.
Além disso, o trabalho de uma vigilância epidemiológica ativa, onde as equipes de saúde promovem o monitoramento dos casos suspeitos para a realização de bloqueios vacinais imediatos é essencial, assim como o controle sanitário em aeroportos e fronteiras, onde os viajantes precisam apresentar o comprovante de vacinação para entrada no país, além de receberem orientações caso apresentem sintomas da doença. “Ainda, é fundamental a relação de cooperação do Ministério da Saúde com os parceiros internacionais, como a Organização Pan-Americana da Saúde (OPAS) e a Organização Mundial da Saúde (OMS), monitorando a evolução da doença globalmente, para adaptação das estratégias brasileiras, conforme a necessidade”, conclui Janize.
Painel de Monitoramento das Arboviroses
Brasil ultrapassa 1 milhão de casos prováveis de dengue em 2025
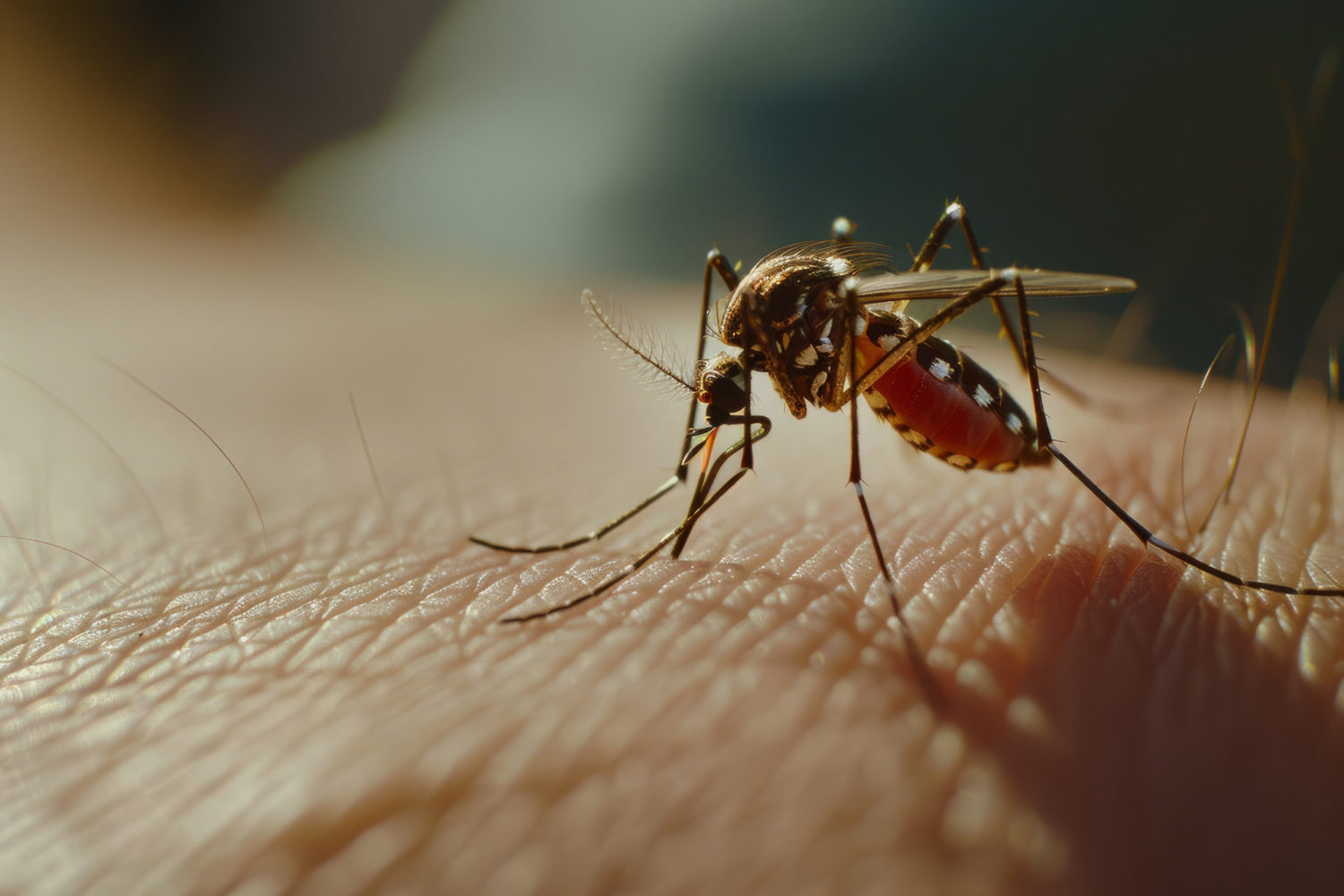
O Brasil registrou, desde 1º de janeiro de 2025, 1.010.833 casos prováveis de dengue. De acordo com o Painel de Monitoramento das Arboviroses do Ministério da Saúde, o país contabiliza ainda 668 mortes confirmadas pela doença e 724 em investigação. O coeficiente de incidência, neste momento, é de 475,5 casos para cada 100 mil pessoas.
A título de comparação, no mesmo período do ano passado, quando foi registrada a pior epidemia de dengue no Brasil, haviam sido contabilizados 4.013.746 casos prováveis e 3.809 mortes pela doença, além de 232 óbitos em investigação. O coeficiente de incidência, à época, era de 1.881 casos para cada 100 mil pessoas.
Em 2025, a maior parte dos casos prováveis se concentra na faixa etária de 20 a 29 anos, seguida pelos grupos de 30 a 39 anos, de 40 a 49 anos e de 50 a 59 anos. As mulheres concentram 55% dos casos e os homens, 45%. Brancos, pardos e pretos respondem pela maioria dos casos (50,4%, 31,1% e 4,8%, respectivamente).
São Paulo lidera o ranking de estados em número absoluto, com 585.902 casos. Em seguida estão Minas Gerais (109.685 casos), Paraná (80.285) e Goiás (46.98 casos). São Paulo mantém ainda o maior coeficiente de incidência (1.274 casos para cada 100 mil pessoas). Em seguida aparecem Acre (888), Paraná (679) e Goiás (639).
-

 Segunda, 14 de abril
Segunda, 14 de abrilSemana começa com 964 oportunidades de emprego no Distrito Federal
-
 Acumulou!
Acumulou!Mega-Sena 2853 pode pagar prêmio de R$ 45 milhões nesta terça-feira (15)
-

 O melhor tempo é agora
O melhor tempo é agoraBrasília 65 anos: confira a programação completa dos três dias de comemorações
-

 Economia
EconomiaGDF vai classificar dívidas ativas para tentar reduzir inadimplência
-

 Taguatinga
TaguatingaAlameda Shopping celebra Páscoa com feira temática e programação especial
-

 Perigos das redes
Perigos das redesDesafio do desodorante: psicóloga faz alerta após morte de criança
-

 E aniversário de Brasília
E aniversário de BrasíliaSemana Santa: confira o que abre e o que fecha no feriado prolongado
-

 26 de abril
26 de abrilDia nacional de prevenção à hipertensão alerta para o controle da doença